


關于蛋白互作的實驗技術,常見的研究蛋白質之間的相互作用的方法如下:免疫共沉澱(Co-IP)、酵母雙雜交、Pull-down、熒光共振能量轉移(FRET)、表面等離子體共振(SPR)等等。
免疫共沉澱
原理
基于抗原-抗體特異性結合,用于研究天然狀态下蛋白質相互作用的經典方法
流程
1.細胞裂解獲取目的蛋白溶液
2.預純化與抗體孵育
3.免疫沉澱富集蛋白與洗雜
4.洗脫互作複合體與分析(WB或質譜檢測)
優點
生理條件下檢測内源性互作,真實可靠,可分離多組分蛋白複合物
局限
靈敏度限制可能無法檢測低親和力或瞬時的相互作用,需高質量抗體,可能産生假陽性,裂解條件需優化以避免破壞互作
Pull-down 實驗
原理
重組蛋白(如GST标簽蛋白)作爲”誘餌”捕獲結合蛋白
類型
1.GST Pull-down 2.His标簽Pull-down
優點
驗證體外直接相互作用
局限
有活性的目的蛋白難表達獲得,不是生理條件下檢測可能存在假陰性
酵母雙雜交系統
原理
轉錄因子拆分後通過蛋白互作重建活性
優點
高通量篩選互作蛋白
局限
限于核内蛋白,存在假陽性/陰性
熒光共振能量轉移(FRET)
原理
熒光共振能量轉移(Fluorescence Resonance Energy Transfer, FRET)是一種基于非輻射能量傳遞的分子間相互作用檢測技術,需熒光标記蛋白
優點
可檢測距離<10nm的相互作用,可實時觀測活細胞動态,無需破碎細胞,保留天然構象與翻譯後修飾狀态
局限
供受體發射光譜重疊導緻假陽性,結果受表達水平、局部pH等因素影響,熒光蛋白體積可能幹擾目标蛋白功能
生物膜幹涉技術(BLI)
原理
基于白光幹涉原理,通過檢測傳感器表面生物膜層厚度變化來實時監測分子相互作用
優點
無需熒光/同位素标記,保留分子天然構象,可定量分析結合動力學,可直接檢測粗提液、血清等複雜樣本
局限
小分子(<150Da)信号較弱,需高濃度樣本,抗原多聚化導緻假陽性(如三明治法需單體抗原),固相化可能改變配體構象,專用傳感器耗材價格較高
新的一年
樂七生物攜手
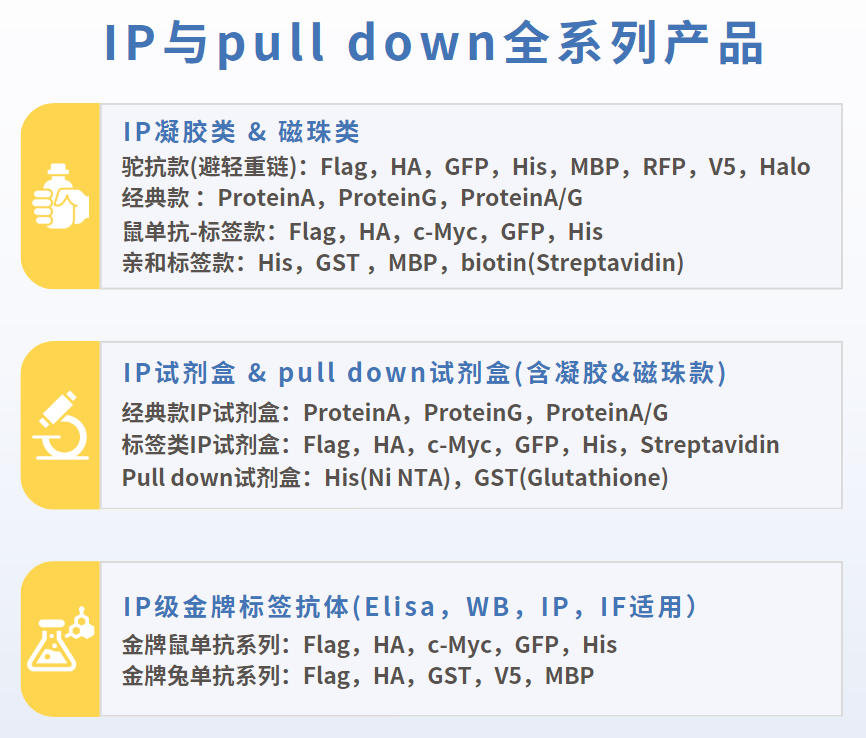
Co-IP與Pulldown全序列beads
磁珠産品以及試劑盒産品
開啓新征程
歡迎廣大新老客戶咨詢選購

手機掃碼可直接訪問該頁面